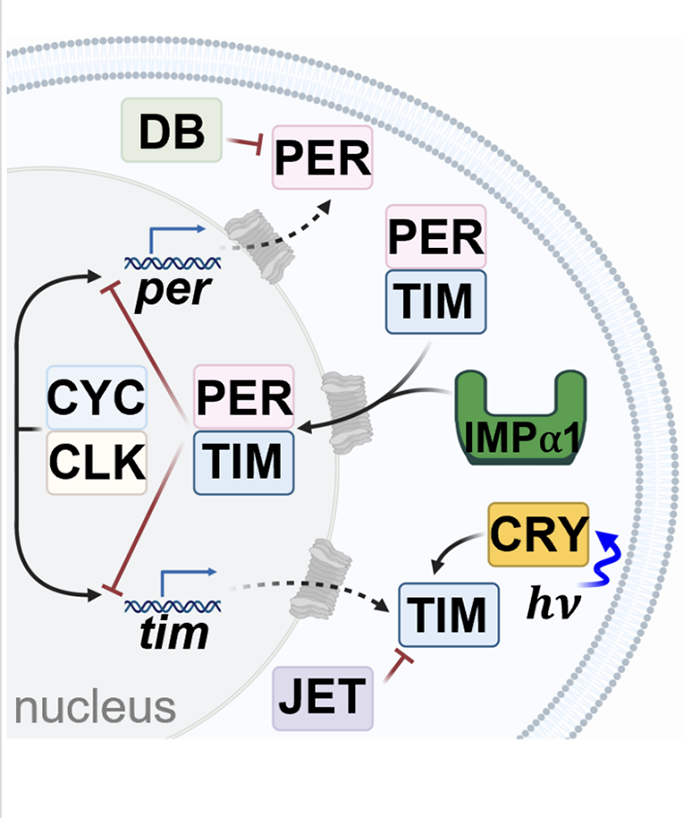
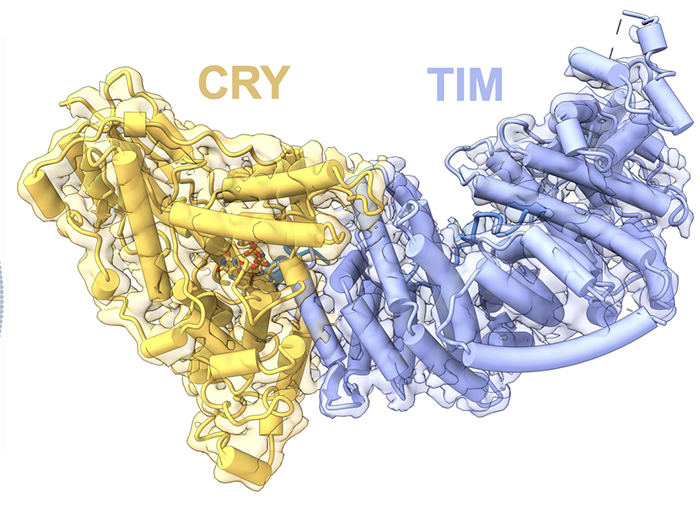
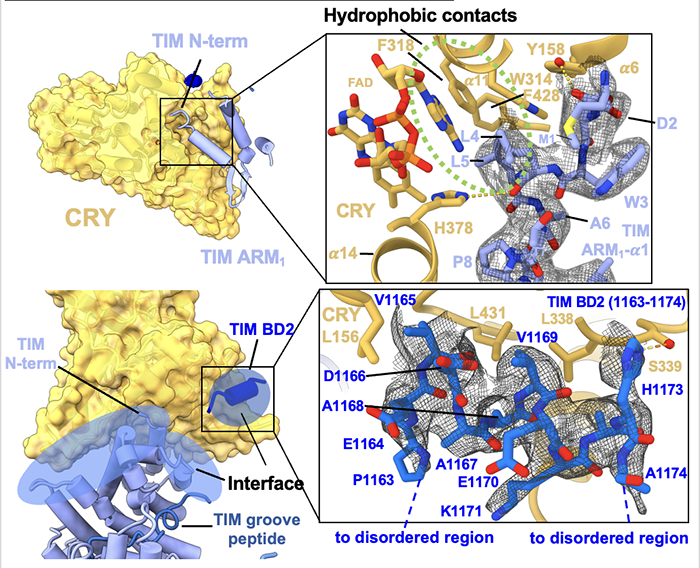
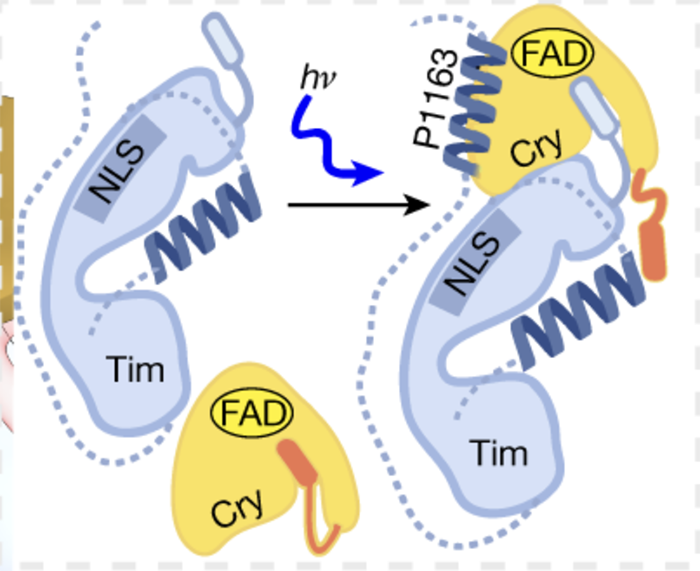
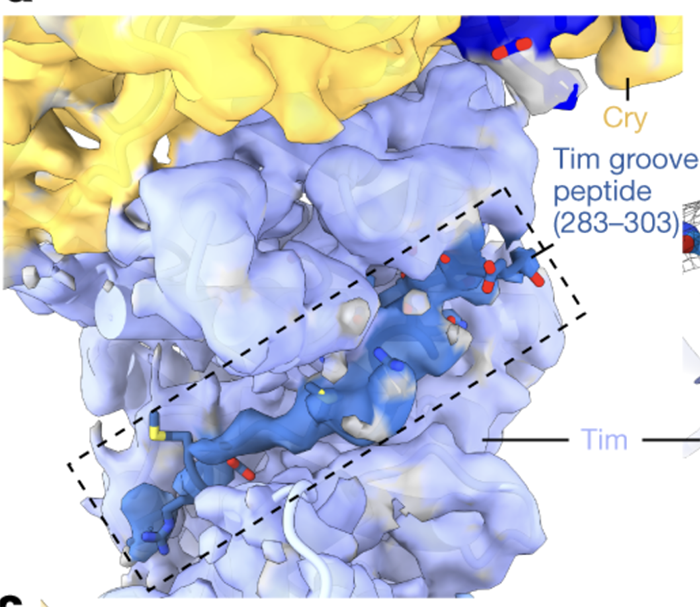
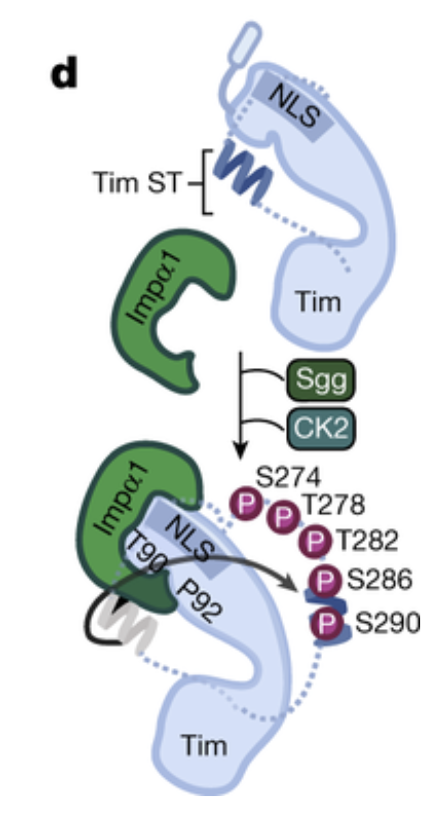
在生物体中,生物钟与环境昼夜变化的同步非常关键。这是一个精密的生理过程,使生物体能够适应不同的环境条件,如光照和温度。生物钟与我们的生活密切相关,它影响我们的睡眠、饮食习惯以及其他生理功能。生物钟,又称昼夜节律,是生物体内调控生理活动的一种自然规律。果蝇作为研究昼夜节律的重要模型生物,科学家们主要关注它们的三个关键蛋白:Cry(感光蛋白)、Tim和Per(Period)。其中,Tim和Per形成的负反馈回路对于维持24小时周期至关重要。随着Tim和Per蛋白的积累,它们会形成复合物进入细胞核,从而抑制自身和其他生物钟信号蛋白的表达,降低其蛋白水平(图1)。因此,负反馈回路使得生物钟重要信号蛋白水平呈现周期变化。另一方面,感光蛋白Cryptochrome (Cry) 在生物钟与环境昼夜变化的同步中发挥了至关重要的作用。光照激活后的Cry发生结构变化,促进其与Tim结合,引发一系列的蛋白降解过程来调节Tim蛋白水平,从而使生物钟与环境昼夜变化同步。因此,近年来,Cry与Tim之间由光照调控的相互作用成为了生物钟昼夜性研究的热点。揭示其结构信息有助于我们理解其感光性、作用机理,并设计改造生物光控工具。然而,由于Tim蛋白具有较大的分子体积和低稳定性,生物学家们多年来难以通过传统手段获得足量的Tim蛋白,使得Cry-Tim复合物的结构研究进展缓慢。2023年4月26日,来自康奈尔大学的林常帆等人(Brian Crane研究组)最近在Nature上发表了文章Cryptochrome–Timeless structure reveals circadian clock timing mechanisms,解决了多年来昼夜节律研究中的难题。作者通过冷冻电镜技术解析出果蝇中感光蛋白Cryptochrome (Cry) 和昼夜节律调控蛋白Timeless(Tim)之间的相互作用机制,为我们对生物钟的深入理解开辟了新途径。林常帆等人采用昆虫细胞体系来表达稳定性较低的蛋白质,并借助该研究组对Cry的研究基础,使用去除末端的Cry变体(称为Cry∆)来提高Tim蛋白的稳定性。为了进一步提高样品纯度以满足冷冻电镜的要求,作者利用基于纳米抗体改造的ALFA tag提高纯化效率,并使用新型化学交联剂DSSO通过共价键稳定复合物结构。同时,作者使用分子排阻柱去除复合物以外的杂质,包括未形成复合物的Cry/Tim单体。这些创新方法帮助作者获得了高质量、高分辨率的复合物结构(图2)。作者发现,庞大的Tim以一种“拥抱”的姿态,通过一端的灵活区域(氨基酸位点1209-1211)和另一端的ARM repeats(Armadrillo repeats,通常由三个α-螺旋构成,形成一个紧凑的右手超螺旋。这些α-螺旋通过短回路相连,并以串联方式排列,形成一个更大的超螺旋结构)与Cry结合(图3)。Tim的ARM repeats与Cry的结合方式为果蝇适应不同地理纬度和光照变化提供了结构学解释。生物学家发现果蝇中的Tim蛋白有两种不同形式,S-Tim和L-Tim(L-Tim的ARM repeats端有额外的23个氨基酸)。自然界不同地区的果蝇中,两种Tim蛋白的比例存在很大差异。研究表明,ARM repeats在Tim与Cry的结合中起到了关键作用。因此,L-Tim中额外的23个氨基酸所带来的结构变化会导致S-Tim和L-Tim具有不同的Cry结合强度。这种结合强度的变化有助于果蝇精确调控自身的生物钟,以适应不同的环境光照。另一方面,文章通过结构分析为长期关注的Cry C端尾巴的作用提供了明确解释。Tim会与Cry C端尾巴竞争结合位点。在黑暗条件下,C端尾巴起到了遮盖结合位点的作用,因此Cry不会与Tim结合。然而,在光照条件下,Cry结构发生变化,C端尾巴从结合位点脱离,从而为Tim提供结合机会(图4)。图4:Tim与Cry C端尾巴竞争结合位点,解释了为何Cry只会在光照下结合Tim作者们还发现了Tim中重要的结构区域——groove,为Tim进入细胞核的机制提供了结构基础 (图5)。先前的研究发现,Tim的核内进入受到磷酸酶Sgg和Ck2以及氨基酸274到290的调控,但具体的作用机制尚不明确。本文的结构分析为此现象提供了解释。Tim groove中的氨基酸90到92是impα1的重要识别位点,有助于Tim进入细胞核。然而,由于groove peptide的遮挡,impα1不能直接结合。当磷酸酶磷酸化位于groove peptide上的氨基酸274到290之后,groove peptide会打开,从而有利于impα1的结合(图6)。综上,本研究利用冷冻电镜技术成功揭示了果蝇光敏感蛋白Cry与昼夜节律调控蛋白Tim之间的分子结构及相互作用机制。同时,对Tim蛋白在细胞核内转运的调控机制提供了有力的解释。这项研究为我们深入理解昼夜节律调控机制奠定了理论基础,并为开发相关治疗策略提供了潜在的靶点。
原文链接:
https://www.nature.com/articles/s41586-023-06009-4